H-2002-小鼠生物净化(新鲜精子IVF+胚胎移植)标准操作规程
1. 目的
为了使实验动物中心生物净化与转基因平台小鼠生物净化(新鲜精子IVF+胚胎移植)实验更加规范,提供优质的技术服务,方便本平台工作人员学习,特制订本标准操作规程。
2. 适用范围
在实验动物中心进行的小鼠生物净化(新鲜精子IVF+胚胎移植)实验。
3. 内容
3.1. 动物需求(B6背景的品系)
3-5周或9-12周的雌鼠;10周以上,最佳12-18周的雄鼠。
3.2. 实验材料
手术器械(剪刀,镊子,止血钳,消毒液等),捡卵管,高压灭菌后的平板纸, 35 mm培养皿, M2 (Sigma:M7167),孕马血清(Pregnant Mare Serum Gonadotropin,简称PMSG)、人绒毛膜促性腺激素(human chorionic gonadotropin,简称HCG,宁波三生生物科技股份有限公司),麻醉剂三溴乙醇。
3.3. 实验流程图
3.4. IVF(B6背景的品系)标准操作流程
3.4.1. Day1,在下午4:00 -7:00 之间对3-5周或9-12周的雌鼠注射PMSG,10 IU/只。
3.4.2. Day3,在注射PMSG 47小时后,给小鼠注射同样量的HCG,10 IU/只。根据早上卵子收集的时间(为了得到质量佳的卵子尽可能的在注射HCG 16-18小时收集)。
3.4.3. Day 4,体外受精(IVF):新鲜精子的IVF
- a) 所需要的培养滴:获能滴TYH 100 μL/滴,受精滴HTF 200 μL/滴(高滴操作);准备采集附睾和输卵管的培养皿(装有500 μl矿物油);洗卵滴(培养滴)HTF 60 μL /滴;最后矿物油覆盖,37 ℃培养箱预热,半小时以上。
图2. 培养滴
图示a是TYH培养滴,b是HTF培养滴,c是洗滴培养滴
- b) 安乐死雄鼠,取附睾尾收集精子;雄鼠腹部朝上,两个大腿根部中间眼科剪剪开皮和肌肉层,暴露出睾丸附睾,取附睾尾。
- c) 手术纸上,去除附睾上残留的脂肪和血。
- d) 显微镜下,获能皿油内采集鲜精:显微剪在附睾尾前端显微剪横切面剪开附睾尾,成熟精子成液滴,显微镊拉入获能滴内获能。
- e) 培养箱内孵育上游1小时左右,精子计数,1 - 25 x 106 精子/mL(经验熟练者,通过眼睛目测判断精子质量,选择获能滴外围游动快的精子)。
- f) 根据获能时间和采集卵子时间,安乐死雌鼠,HCG16-18小时后,取输卵管收集卵子。
- g) 手术纸上,去除输卵管上残留的的脂肪和血。
- h) 受精皿油内采集卵子,显微镊撕破输卵管膨大部,带有卵丘细胞的卵子游离出来,拉入受精滴内。
- i) 获能后的精子加入受精滴内,3-5 μL /滴。
- j) 受精4-6小时后,捡卵,洗涤死精和颗粒细胞。将正常形态的卵细胞转移到洗涤培养皿内,洗涤2遍。
- k) 过夜培养,收集2细胞胚胎。
3.4.4. Day 5:胚胎移植,转移胚胎(2细胞胚胎)到假孕受体内或在M16培养液内培养,根据实验要求进行实验。
- a) 计算有多少枚胚胎需要移植,需要多少只受体。
- b) 取受体雌鼠,称重并用阿佛丁麻醉(0.12-0.15 mL/10 g)进行麻醉。
- c) 待雌鼠麻醉后用眼科弯剪或者推子去掉背部毛发,然后75 %酒精棉球消毒。
- d) 受体背部开口,左手持组织镊夹起表皮,右手用眼科在受体背部剪开一个竖向切口。
- e) 用组织镊伸到背部表皮左侧,找准输卵管位置,组织镊撕开一个小口,找到输卵管。
- f) 用镊子夹住卵巢脂肪,轻轻拉出,用动脉夹夹住卵巢脂肪,逆时针旋转,将膨大部置于表面。
- g) 在体式镜下观察是否有膨大部,然后用显微镊夹起一小块滤纸片摆正膨大部位置,方便移植。
- h) 拿出含有需要移植的胚胎的培养皿,用捡卵管转移2细胞期胚胎(立体亮圆),在M2液滴里洗三遍,去除矿物油。
- i) 用移植针先做两个气柱,再吸取2细胞期胚胎,将捡卵管放置在体式镜上方,便于拿取。
- j) 左手持显微镊夹住膨大部第一个拐弯的上游,右手用1 mL注射器打孔。
- k) 将移植针从刚才打孔位置伸入至膨大部上方,确保进去后,吹出胚胎,如果看见有1到2个气泡进入膨大部即为移植成功。
- l) 缝合本侧肌肉层,按照同样步骤移植另外一侧,最后缝合表皮,并用75 %酒精棉球消毒。
- m) 将移植后的小鼠两只一笼放入新笼,标注品系名称、移植受精卵数量、移植人,移植日期。
4. 注意事项
IVF即在体外环境下,获能的精子和成熟的卵子相混合,完成受精的过程。IVF中注意事项如下,
4.1. 透明带硬化
随着时间的变化,精子越来越难进入透明带。卵子在体外时间越长,透明带会变得越硬化。收集卵子时切记要快。
4.2. 温度至关重要
尽可能任何东西都保持在37 ℃。在显微镜旁边设立一个小的培养箱,尽量使受精皿少暴露在室温和大气中。
4.3. 时间很重要
精子获能时间一般30 min-50 min,决定了精子活力。一般情况下,冷冻精子和精子差小鼠品系,获能时间30 min。精卵孵育时间是4-6 h,不是孵育时间越久越好。
4.4. PH值也很重要
在空气中,培养液的PH值会很快升高。尽量保持受精滴在培养箱内。
4.5. 空气环境尽可能接近屏障环境指标
实验室内挥发性的有机化合物很大程度影响IVF的成功和移植后胚胎的发育能力,实验室环境应维持在最佳空气状态下。
5. 技术要点
5.1. 促性腺激素
每批次激素效果也存在不同,请选择来源稳定的供应商。除了激素本身,影响小鼠激素超排的因素较多,主要有腹腔注射,实验小鼠品系,周龄和营养状态,激素注射剂量等。
激素超排,请选择小鼠的右腹进行腹腔注射。杂交系小鼠品系激素超排要好于近交系和封闭群,BALB/c小鼠激素超排很不稳定,一般选择4周龄或者8周龄。其他小鼠品系选择最佳周龄3-5周或者9-12周,避开6-8周的激素不敏感期。不同实验室在注射剂量上存在较多差异,多选择5-10 IU/只不等,平台选择10 IU/只。注射过一次激素的雌鼠,需要等2周后可以安排激素处理。
5.2. 实验体系
新鲜精子采用TYH 100 μL,HTF100+100 μL(高滴),洗涤培养皿根据胚胎数量而定,1 μL /1枚胚胎。
冷冻精子采用TYH 90 μL,HTF45+45 μL(高滴)添加GSH(现配现用,称量0.0307 g谷胱甘肽放到EP管内,用1 mL HTF溶解,过滤。取过滤后试剂10 μL加入1 mL HTF试剂中,混匀后做受精滴,以此类推。这种受精滴用于冻精复苏或者精子不好品系),洗涤培养皿根据胚胎数量而定,1 μL /枚胚胎。
精子差的品系采用TYH 60 μL,HTF100+100 μL(高滴)添加GSH,1 μL /枚胚胎。
5.3. 胚胎移植
操作简单但是是实验体系中关键的步骤。ICR受体使用体重30-40 g左右,见栓0.5天受体膨大部明显,没有膨大部的受体不能使用,该受体可以移植原核期到囊胚期的任何阶段的胚胎。见栓2.5天受体可以移植囊胚期胚胎。
不同方式来源的胚胎假孕受体移植数量不同,体内胚胎双侧20枚左右,单侧15枚左右。体外操作的胚胎建议采用双侧移植30枚左右。
5.4. 矿物油
矿物油是小鼠胚胎操作技术实验中容易忽略的一部分。每批次矿物油必须进行胚胎培养验证,严格避光保存,不能照射紫外。实验过程中不能随意带入下一步的操作中。
以上文件版权和解释权归清华大学实验动物中心所有。
附录
1. 试剂配方
1.1. TYH配方
1.2. HTF配方
注:试剂配制都需要添加双抗和酚红。
2. 小鼠体外受精(IVF)技术质量图鉴
旨在通过小鼠精子质量及排卵数量,合理估算小鼠鲜精IVF后2细胞发育率,从而安排下一步实验。
2.1. 精子质量
2.1.1. 附睾尾形态
推荐选用12-18周最佳周龄的健康雄鼠。附睾尾应左右两侧大小均匀、饱满,镜下观察精子充满曲精管,无透明状态。若雄鼠周龄偏小,则附睾尾偏小,镜下呈现透明状,内里无精子。如图1所示。

图示a是12-18周雄鼠附睾尾,b是小于12周雄鼠附睾尾,c是两种附睾尾对比
此外,健康状态差或年龄较大的雄鼠会出现无精、死精(镜下观察精子无自由溢出),附睾尾不饱满,左右侧差异较大等情况。如图2所示。

图示a是附睾尾透明无精,b是死精不扩散,c是附睾尾形态异常
2.1.2. 精子扩散
除了依据附睾状态外,我们还可以根据镜下精子扩散情况,进一步判断精子质量的优劣。如图3所示。
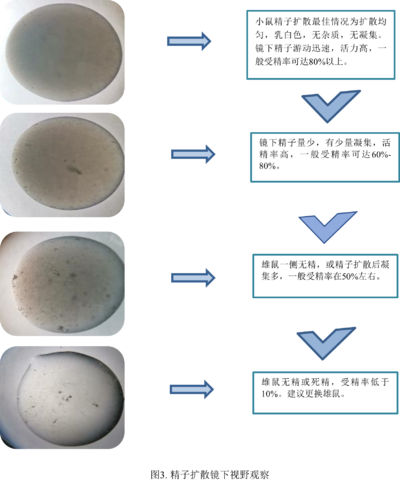
3. 排卵
推荐选用3-5周或9-12周雌鼠,在注射HCG 16-18小时后收集卵子。适龄雌鼠(除特殊品系,例DBA等外)超排后小鼠镜下壶腹部膨大明显。排卵佳。对激素作用不敏感期的小鼠超排后镜下壶腹部无膨大,排卵差。如图4所示。

图示a是明显的膨大部,b是没有膨大部
4. 洗胚
精子和卵子混合4-6小时后,洗胚时去除非正常形态卵细胞,如图5所示保留正常受精后。
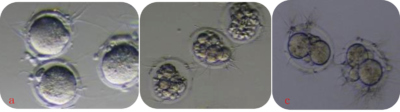
图示a是正常受精后胚胎,b是畸形胚胎,c是透明间隙大胚胎
5. 参考文献
- 清华大学实验动物中心SOP及网站。本网站已经获得使用许可,转载。其他网站使用,请联系用户:Changzai